Bazele neurochimice ale schizofreniei
- Ipoteza dopaminei continuă să fie o teorie neurobiologică validă privind schizofrenia1, 2.
- Receptorii de dopamină relevanți pentru psihopatologia schizofreniei au tipare de distribuție, afinități și caracteristici diferite în creierul uman.
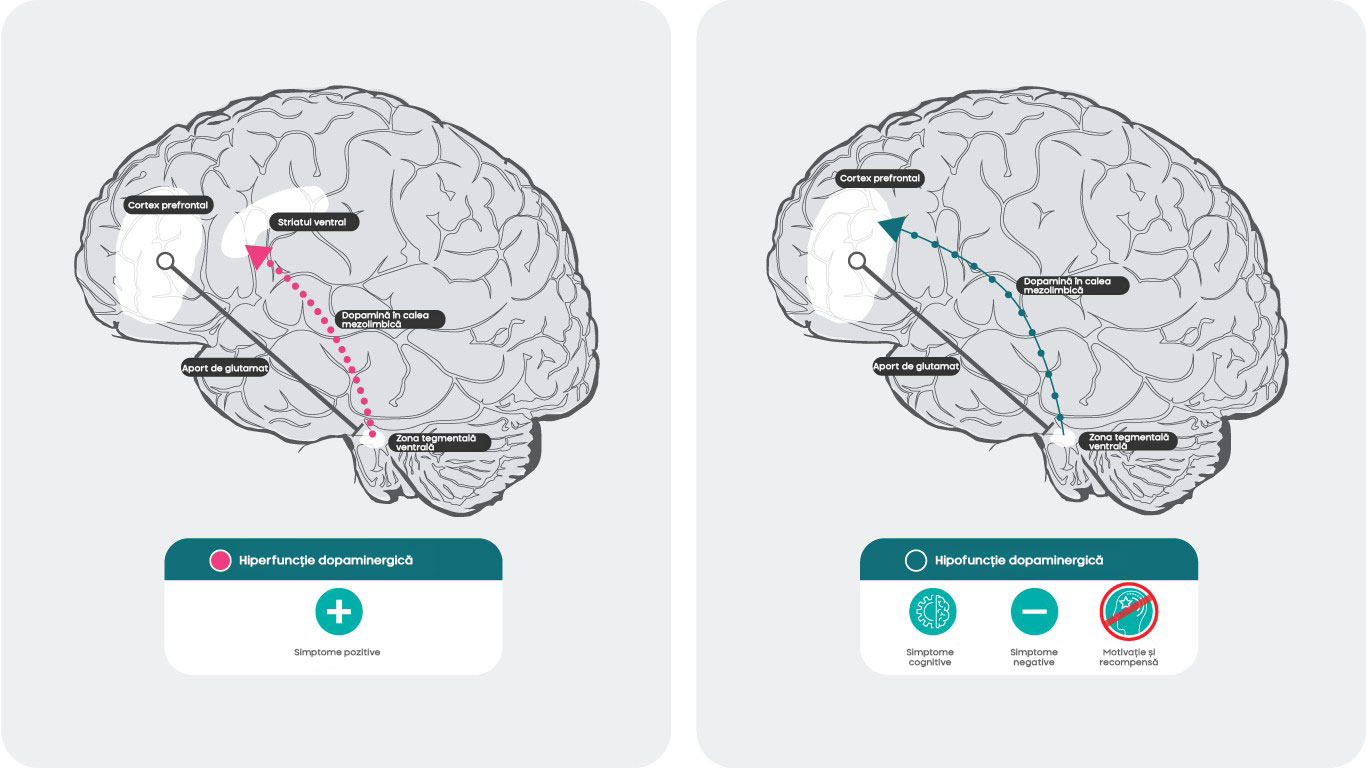
- În schizofrenie, simptomele pozitive sunt considerate a fi asociate cu o stare hiperdopaminergică în sistemul mezolimbic, în timp ce o stare hipodopaminergică din sistemul mezocortical a fost asociată cu simptomele negative și cognitive.
În această secțiune
Ipoteza dopaminei
Ipoteza dopaminei privind schizofrenia a început ca o teorie bazată pe dovezile circumstanțiale obținute din observațiile clinice în urma tratamentului antipsihotic și a avansat până în faza curentă, în care studiile imagistice pot asigura testarea și validarea directă, permițând o înțelegere superioară a mecanismelor patofiziologice subiactente din cadrul schizofreniei3.
Dopamina și creierul activ
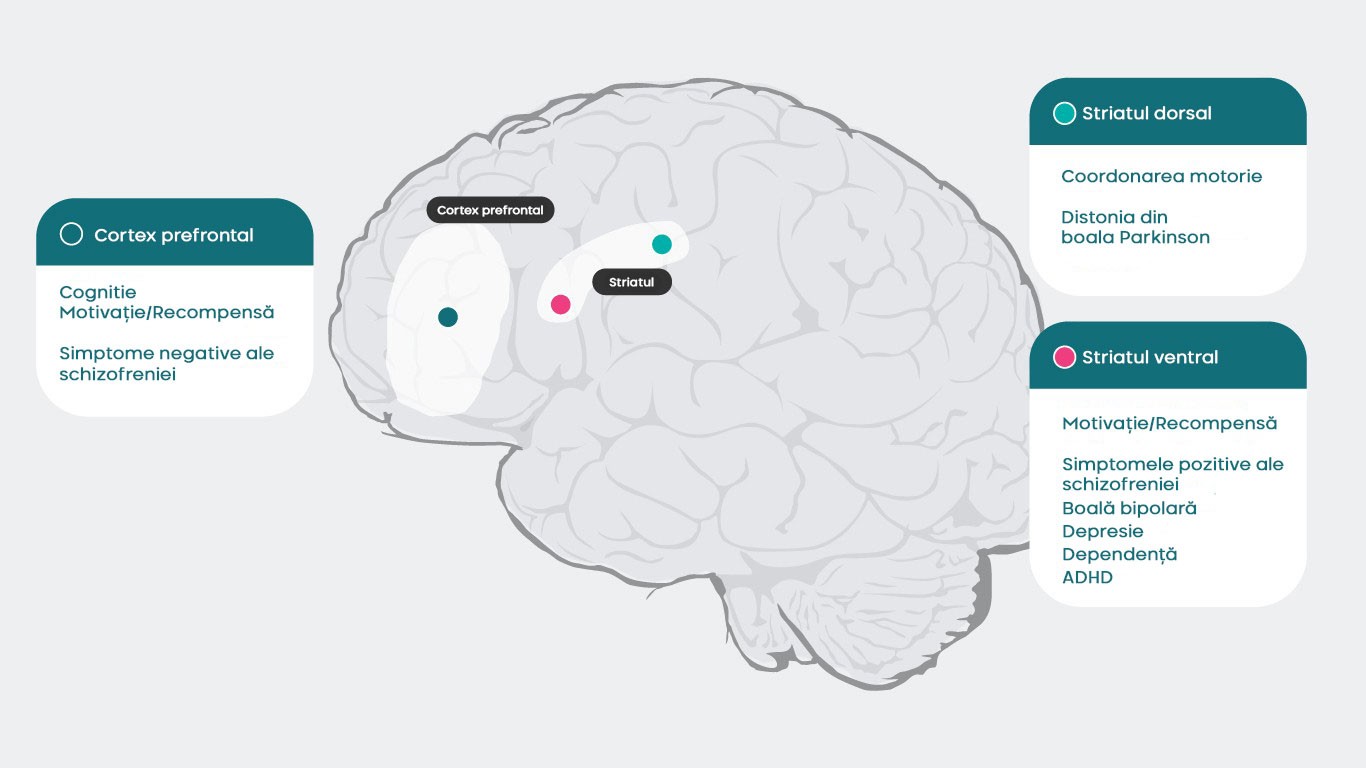
Deoarece dopamina are acțiuni specifice pentru fiecare subtip de receptor, care sunt responsabile pentru o gamă largă de funcții psihice și neurologice (cortexul prefrontal: cogniția5, motivația/recompensa6–10, simptomele negative ale schizofreniei11 striatul dorsal: controlul motor12, boala Parkinson1, distonia1 striatul ventral: motivația/recompensa6–10, simptomele pozitive ale schizofreniei11,13, tulburarea bipolară14, depresia8, dependența15, ADHD16, întreruperea acestor procese poate genera numeroase simptome asociate bolilor psihice.
Medicamentele psihotrope care au activitate la nivelul receptorilor dopaminergici pot îmbunătăți numeroase dintre aceste simptome, deși o mai bună înțelegere a funcției dopaminei în diferite regiuni ale creierului și a mecanismelor subiacente schizofreniei sunt necesare pentru a înțelege în totalitate modul în care antipsihoticele vizează neurotransmiterea dopaminergică și tratează schizofrenia4.
Referințe: Adaptat din Stahl SM. Essential Pharmacology 4th edition 20131 ; Cools R, D’Esposito M. Biol Psychiatry. 2011;69(12):e113-125.5; Hamid AA, et al. Nat Neurosci. 2016;19(1):117-126.6; Koob GF, et al. NIDA Res Monogr. 1994;145:1–187; Biesdorf C, et al. Neurobiol Learn Mem. 2015;123:125-1398; Der-Avakian A, et al. Trends Neurosci. 2012 Jan;35(1):68-77.9; Leggio GM, et al. Eur Neuropsychopharmacol. 2008 Apr;18(4):271-7.10; Stahl SM. Prim Care Companion J Clin Psychiatry.2003;5(3)9-1311; Plowman EK, et al. J Parkinsons Dis. 2011;1(1):93-10012; Dichter GS, et al. J Neurodev Disord. 2012;4:19513; Ashok AH, et al. Mol Psychiatry.2017 May;22(5):666–67914; Orio L, et al. Addict Biol. 2010;15(3):312-32315; Volkow ND, et al. J Neurosci. 2012;32(3):841-84916.
Subtipurile de receptori ai dopaminei
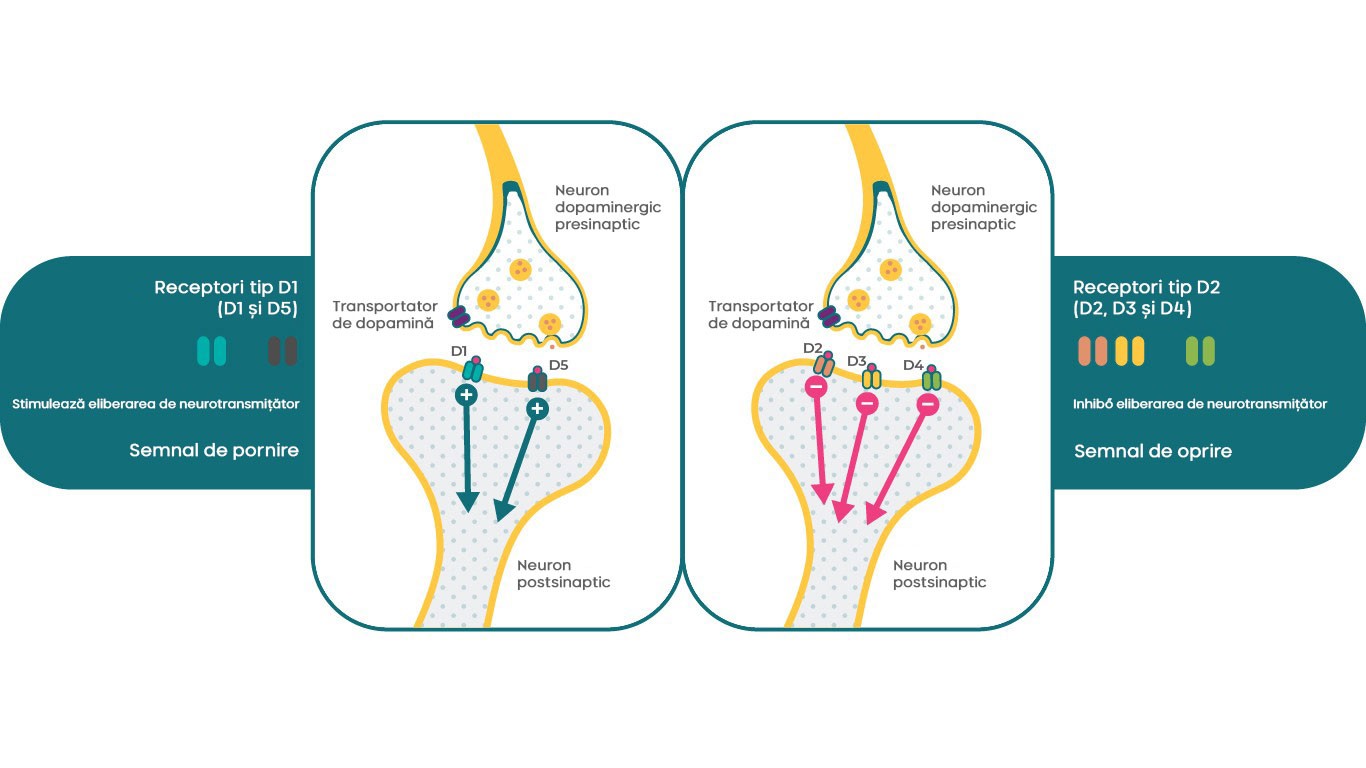
Există 5 tipuri de receptori dopaminergici, care pot fi împărțiți în 2 clase principale. Familia de receptori tip D1 include receptorii de dopamină D1 și D5, în timp ce familia de receptori tip D2 constă din receptorii D2, D3 și D4. Din punct de vedere clinic, de regulă D2, D3 și D1 sunt considerați cei mai relevanți receptori pentru patofiziologia schizofreniei. În funcție de subtipul de receptor, receptorii dopaminergici pot avea diferite efecte asupra aceluiași sistem de transmitere secundar cu un receptor servind drept semnal de „oprire”, în timp ce alte subtipuri pot servi drept semnal de „pornire”4. De exemplu, receptorii D1 pot stimula cAMP, în timp ce receptorii D2 și D3 pot inhiba acest transmițător secundar.
În acest mod, receptorii dopaminei D1, D2 și D3 pot deservi funcții neurobiologice foarte specifice dar diferite în prezența dopaminei, ceea ce permite unui neurotransmițător să controleze diferite stări fiziologice, comportamentale și patologice4, 17.
Referințe: Adaptat din Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017)4
Afinitățile receptorilor dopaminei
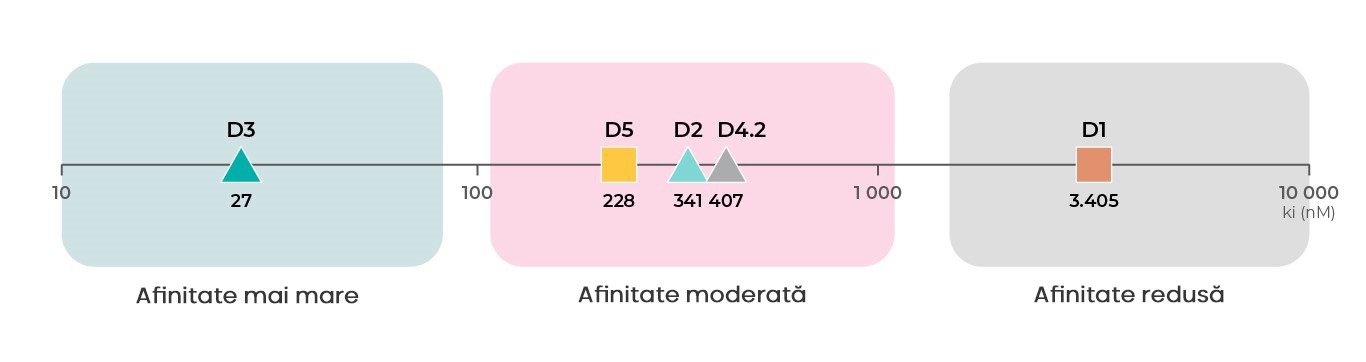
În plus față de funcțiile diferite ale subtipurilor de receptori ai dopaminei, fiecare subtip de receptor dopaminergic are o altă afinitate pentru dopamină. Pe baza datelor de legare din baza de date PDSP Ki, receptorii D319 au cea mai mare afinitate pentru dopamină, urmați de receptorii D219,20, D421 și D518 cu afinități intermediare, iar apoi vin receptorii D118,19 cu cea mai redusă afinitate pentru dopamină4.
Referințe: All binding data are from PDSP Ki database.
Affinity to D1 subtype: Toll L, NIDA Res Monogr 1998, 178:44046619 ; Sunahara RK, Nature 1991, 350:614-61918
Affinity to D2 subtype: Michaelides MR 1995, J Med Chem 38:3445-344720; Toll L, NIDA Res Monogr 1998, 178:44046619
Affinity to D3 subtype: Toll L, NIDA Res Monogr 1998, 178:44046619; Cussac D, Naunyn Schmied Arch Pharmacol 2000, 361:569-572;
Affinity to D4 subtype: Tallman JF, J Pharm Exp Ther 1997, 282:1011-101921;
Affinity to D5 subtype: Sunahara RK, Nature 1991, 350:614-61918; Stahl SM, CNS Spect 2016, 21:123-12722.
Distribuția receptorilor dopaminergici4,22-27
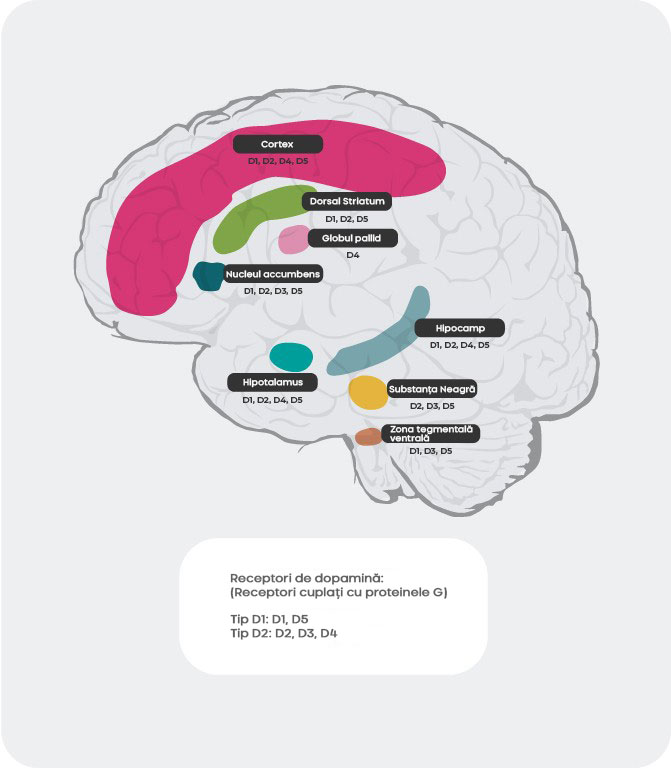
Dincolo de diferitele afinități, distribuirea subtipurilor receptorilor dopaminergici în creier diferă. De exemplu, eliberarea hiperactivă de dopamină la nivelul receptorilor postsinaptici D2 din striatul ventral este considerată responsabilă de simptomele pozitive psihotice. Drept urmare, receptorii dopaminei D2 reprezintă principalul obiectiv al majorității antipsihoticelor folosite pentru tratarea schizofreniei. Receptorii D3 sunt foarte bine reprezentați în zonele limbice, hipotalamus și zona tegmentală ventrală/substantia nigra, zonele considerate implicate în reglarea cogniției, dispoziției și motivației. În cortexul prefrontal, unde reprezentarea receptorilor dopaminei D2 și D3 este redusă, neurotransmisia dopaminei este mai puternic controlată de receptorii postsinaptici D1.
Referințe: Adaptat din Stahl, CNS spec. 2017;22:305-31118; Fatemi SH. The medical basis of psychiatry. 4th edition. Sringer 2016;p93-9427
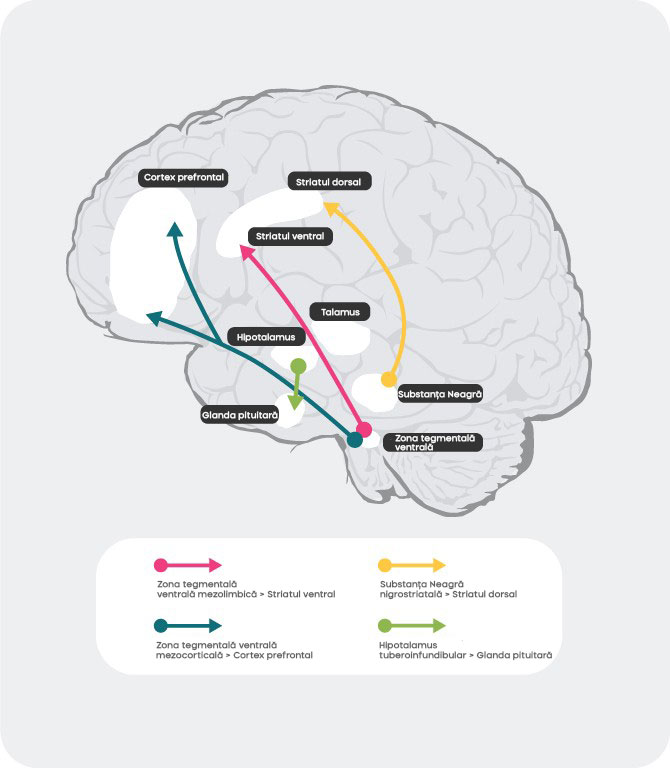
Căile dopaminergice
Există 4 căi dopaminergice majore în creierul uman: calea mezolimbică, mezocorticală, nigrostriatală și tuberoinfundibulară27:
• calea mezolimbică: calea mezolimbică, cunoscută și drept calea recompensei, transmite dopamina din zona tegmentală ventrală (VTA) către striatul ventral. Zona tegmentală ventrală se află în mezencefal și striatul ventral se află în prozencefal și include atât nucleul accumbens cât și bulbul olfactiv.
• calea mezocorticală: calea mezocorticală, despre care se crede că este implicată în cogniție și emoții, transmite dopamina din zona tegmentală ventrală către cortexul prefrontal.
• calea nigrostriatală: calea nigrostriatală, care este implicată în reglarea mișcărilor, transmite dopamina din substantia nigra pars compacta (SNc), situată în mezencefal, la nucleul caudat și putamen, aflați în striatul dorsal.
• calea tuberoinfundibulară: calea tuberoinfundibulară transmite dopamina de la nucleul infundibular al hipotalamusului către glanda pituitară. Această cale reglează secreția hormonilor glandei pituitare, inclusiv prolactina.
Referințe: Adaptat din Fatemi SH. The medical basis of psychiatry. A 4-a ediție. Sringer 2016;p 93-9427
Dopamina și schizofrenia
Ipoteza dopaminei privind schizofrenia sugerează că neurotransmiterea hiperactivă dopaminergică în regiunile cerebrale subcorticală și limbică este asociată cu simptomele pozitive de schizofrenie30, în timp ce hipofuncționalitatea proiecțiilor dopaminergice mezocorticale în cortexul prefrontal poate fi mai mult responsabilă pentru simptomele negative și cognitive31,32.
Referință: Adaptat din Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29(2): 97–115.; 35. Elert E, Nature 2014. 508. s2-s329
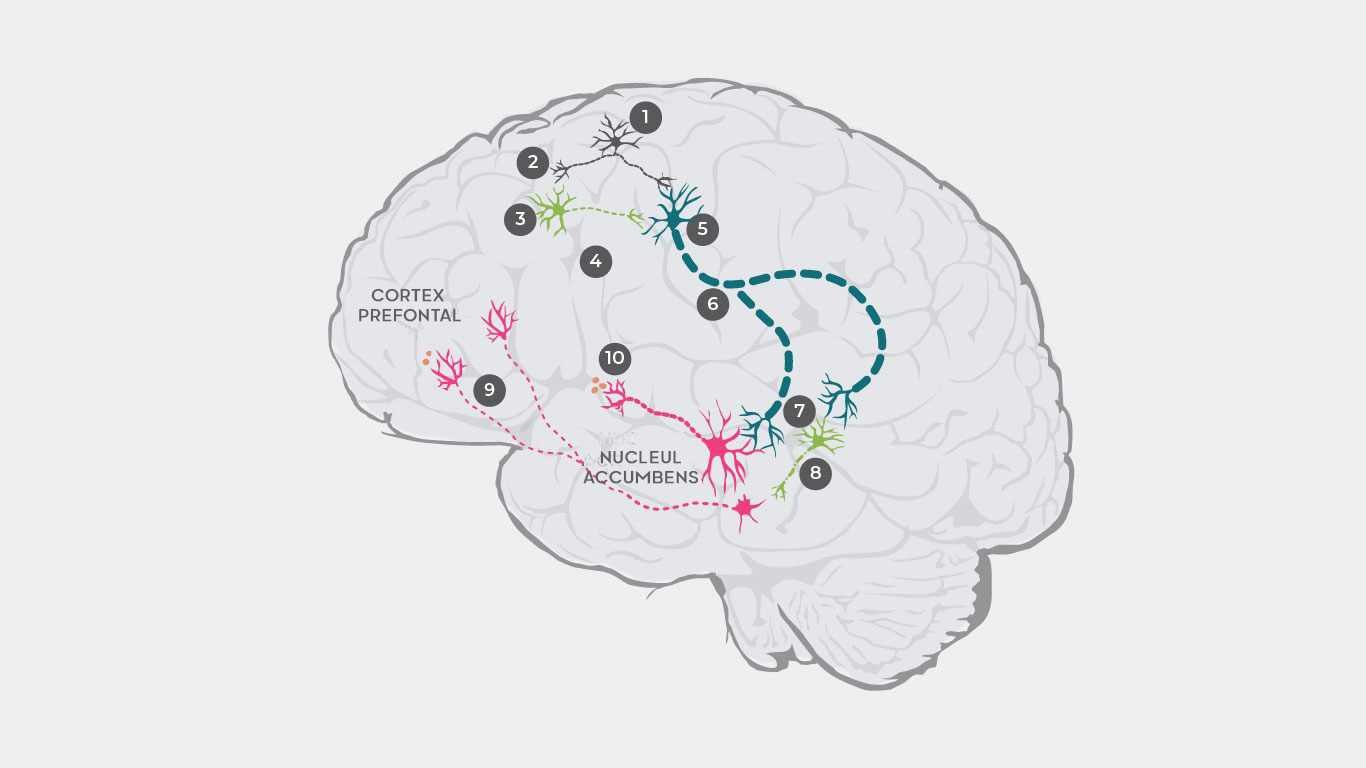
Mai multe teorii privind dereglările dopaminei au fost furnizate pentru a explica patofiziologia schizofreniei33, 34. De exemplu, cercetările au estimat că patofiziologia schizofreniei poate fi determinată în primul rând de o dereglare a glutamatului, care determină un dezechilibru dopaminergic35.
• Cascada începe cu neuronii glutamatergici care declanșează și trimit un impuls electric1 care determină eliberarea de glutamat în sinapsă2.
• În cazul unui om sănătos, glutamatul se leagă apoi de receptorii neuronilor GABA inhibitori și neuronii glutamatergici excitatori. Cu toate acestea, la pacienții cu schizofrenie, legarea glutamatului de neuronii GABA este afectată3, ceea ce determină neurotransmițătorii inhibitori să nu fie eliberați4. Cu toate acestea, glutamatul va rămâne legat de neuronii glutamatergici excitatori, iar în absența neuronilor GABA inhibitori5 se trimite un semnal crescut către trunchiul cerebral6.
• Prin urmare, în sinapsă se eliberează prea mult glutamat, hiperstimulând atât neuronii dopaminergici, cât și alți neuroni GABA inhibitori7.
• Neuronii GABA hiperstimulați suprainhibă un neuron dopaminergic diferit, suprimându-i astfel activitatea8. Acest neuron dopaminergic hipoactiv transmite semnale intermitente de la regiunea tegmentală ventrală la cortexul prefrontal, unde se secretă prea puțină dopamină9, ceea ce duce la starea hipodopaminergică în sistemul mezocortical care, la rândul său, duce la manifestarea simptomelor negative1.
• Prin urmare, acești neuroni dopaminergici hiperstimulați transportă semnale excesive din regiunea tegmentală ventrală la striatul ventral, determinând eliberarea unei cantități prea mari de dopamină10, ceea ce duce la exces de dopamină în sistemul mezolimbic și apariția simptomelor pozitive.
Referință: Adaptat din Stahl SM. 4th ed. New York, NY: Cambridge University Press; 20131; Howes J Psychopharmacol. 2015 February; 29 (2): 97–11529; Elert Nature volume 508, pages S2–S3 (03 April 2014)35;
Cercetările arată că neurotransmiterea crescută la nivelul receptorului D2 în regiunile subcorticală și limbică a creierului contribuie la simptomele pozitive31,32. Cu toate acestea, mecanismele care dau naștere simptomelor negative și cognitive nu sunt foarte clare.
În prezent, se presupune că eliberarea scăzută de dopamină în cortexul prefrontal este determinată de activarea autoreceptorilor D3 dopaminergici presinaptici din regiunea tegmentală ventrală care transmit în cortexul prefrontal. Dintre subtipurile de receptori ai dopaminei, receptorii D3 au cea mai mare afinitate pentru dopamină. Spre deosebire de receptorii D1 sau D2, receptorii D3 pot fi stimulați chiar și în cazul unei eliberări reduse de dopamină, care poate „modula” efectele fluctuării de la episoadele bruște de eliberare de dopamină fazică. Blocarea acestei atenuări dezinhibă eliberarea de dopamină și sporește neurotransmiterea. Această creștere a dopaminei poate inversa starea hipodopaminergică și poate determina îmbunătățiri ale simptomelor negative și ale cogniției prin activarea receptorilor D1 din cortexul prefrontal, care nu sunt activi în cazul unui nivel redus de dopamină32.
La animale, inclusiv studiile pe primate, cele mai favorabile efecte cognitive sunt obținute atunci când activitatea receptorului D1 este optimizată în cortexul prefrontal. Prea multă dopamină, la fel ca și prea puțină activitate dopaminergică la nivelul receptorilor D1, sunt asociate cu disfuncții cognitive. Ipotetic, medicamentele care ori blochează, ori hiperstimulează receptorii D1 pot deregla stimularea dopaminei și pot contribui la apariția simptomelor cognitive, negative și de dispoziție, generând o lipsă de armonie la neurotransmiterea de la nivelul sinapselor corticale. De asemenea, este posibil ca antagoniștii receptorului D3 să dezinhibeze eliberarea de dopamină și să armonizeze circuitele corticale care, la rândul lor, pot duce la o reglare îmbunătățită a simptomelor cognitive, de dispoziție și negative4.
Referințe
- Stahl, S. M. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. (Cambridge University Press, 2013).
- Seeman, P. Schizophrenia and dopamine receptors. Eur. Neuropsychopharmacol. 23, 999–1009 (2013).
- Kaar, S. J., Natesan, S., McCutcheon, R. & Howes, O. D. Antipsychotics: Mechanisms underlying clinical response and side-effects and novel treatment approaches based on pathophysiology. Neuropharmacology (2019). doi:10.1016/j.neuropharm.2019.107704
- Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017).
- Cools, R. & D’Esposito, M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry 69, e113-125 (2011).
- Hamid, A. A. et al. Mesolimbic dopamine signals the value of work. Nat. Neurosci. 19, 117-126. (2016).
- Koob, G. F., Caine, B., Markou, A., Pulvirenti, L. & Weiss, F. Role for the mesocortical dopamine system in the motivating effects of cocaine. NIDA Res. Monogr. Ser. 145, 1-18. (1994).
- Biesdorf, C. et al. Dopamine in the nucleus accumbens core, but not shell, increases during signaled food reward and decreases during delayed extinction. Neurobiol. Learn. Mem. 123, 125–139 (2015).
- Der-Avakian, A. & Markou, A. The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 35, 68–77 (2012).
- Leggio, G. M., Micale, V. & Drago, F. Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test (FST). Eur. Neuropsychopharmacol. 18, 271–277 (2008).
- Stahl, S. M. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim. Care Companion J. Clin. Psychiatry 5, 9–13 (2003).
- Plowman, E. K., Thomas, N. J. & Kleim, J. A. Striatal dopamine depletion induces forelimb motor impairments and disrupts forelimb movement representations within the motor cortex. J. Parkinsons. Dis. 1, 93–100 (2011).
- Dichter, G. S., Damiano, C. A. & Allen, J. A. Reward circuitry dysfunction in psychiatric and neurodevelopmental disorders and genetic syndromes: Animal models and clinical findings. J. Neurodev. Disord. 4, 19 (2012).
- Ashok, A. H. et al. The dopamine hypothesis of bipolar affective disorder: The state of the art and implications for treatment. Mol. Psychiatry 22, 666–679 (2017).
- Orio, L., Wee, S., Newman, A. H., Pulvirenti, L. & Koob, G. F. The dopamine D3 receptor partial agonist CJB090 and antagonist PG01037 decrease progressive ratio responding for methamphetamine in rats with extended-access. Addict. Biol. 15, 312–323 (2010).
- Volkow, N. D. et al. Methylphenidate-elicited dopamine increases in ventral striatum are associated with long-term symptom improvement in adults with attention deficit hyperactivity disorder. J. Neurosci. 32, 841–849 (2012).
- Beaulieu, J. M., Espinoza, S. & Gainetdinov, R. R. Dopamine receptors – IUPHAR review 13. Br. J. Pharmacol. 172, 1–23 (2015).
- Sunahara, R. K. et al. Cloning of the gene for a human dopamine D5 receptor with higher affinity for dopamine than D1. Nature 350, 614–619 (1991).
- Toll, L. et al. Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications. NIDA Res. Monogr 178, 440–466 (1998).
- Michaelides, M. R. et al. (5aR, 11bS)-4,5,5a,6,7, 11b-hexahydro-2-propyl-3-thia-5-azacyclopent-1-ena[c]-phenanthrene-9,10-diol (A-86929): A potent and selective dopamine D1 agonist that maintains behavioral efficacy following repeated administration and characterization of its dia. J. Med. Chem. 38, 3445–3447 (1995).
- Tallman, J. F. et al. Ngd 94-1 – identification of a noval, high-affinity antagonist at the human dopamine D-4 receptor 1. J. Pharmacol Exp Ther 282, 1011–1019 (1997).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Mengod, G. et al. Visualization of dopamine D1, D2 and D3 receptor mRNA’s in human and rat brain. Neurochem. Int. 20, Suppl:33S-43S (1992).
- Meador-Woodruff, J. H. et al. Dopamine receptor mRNA expression in human striatum and neocortex. Neuropsychopharmacology 15, 17–29 (1996).
- Fuxe, K. et al. Dopaminergic Systems in the Brain and Pituitary. in Basic and Clinical Aspects of Neuroscience (eds. Flückinger, E., Müller, E. E. & Thorner, M. O.) (Springer, 1985). doi:10.1007/978-3-642-69948-1_2
- Fatemi, S. H. & Clayton, P. J. The medical basis of psychiatry: Fourth edition. The Medical Basis of Psychiatry: Fourth Edition (2016). doi:10.1007/978-1-4939-2528-5
- Howes, O. D. & Kapur, S. The dopamine hypothesis of schizophrenia: Version III – The final common pathway. Schizophr. Bull. 35, 549–562 (2009).
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizophrenia: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Desbonnet, L. Modeling the Psychopathological Dimensions of Schizophrenia. in Handbook of Behavioural Neuroscience 267–284 (2016).
- Toda, M. & Abi-Dargham, A. Dopamine hypothesis of schizophrenia: Making sense of it all. Curr. Psychiatry Rep. 9, 329–336 (2007).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Grace, A. A. & Gomes, F. V. The circuitry of dopamine system regulation and its disruption in schizophrenia: Insights into treatment and prevention. Schizophr. Bull. 45, 148–157 (2019).
- Grace, A. A. Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 17, 524–532 (2016).
- Elert, E. Aetiology: Searching for schizophrenia’s roots. Nature 508, S2-3 (2014).
CNS Spectrums
Dazzled by the dominions of dopamine: clinical roles of D3, D2, and D1 receptors.
ANTIPSIHOTICELE, DIFERITE... ANTIPSIHOTICELE, DIFERITE...
Profilul eficacității clinice al agenților antipsihotici tipice pare să depindă de afinitatea mare pentru și activitatea antagonistă completă de la receptorii Profilul eficacității clinice al agenților antipsihotici tipice pare să depindă de afinitatea mare pentru și activitatea antagonistă completă de la receptorii
continuă…CUM FUNCȚIONEAZĂ CARIPRAZINA? CUM FUNCȚIONEAZĂ PRODUSUL NOSTRU?
(COD: 300020/R06. Trimis către AIFA 16/04/2020) Cariprazina are o afinitate ridicată pentru receptorii dopaminergici D3 și D2 precum și receptorii de (COD: 300020/R06. Trimis către AIFA 16/04/2020) Cariprazina are o afinitate ridicată pentru receptorii dopaminergici D3 și D2 precum și receptorii de
continuă…